대부분의 효소의 활성은 항상 일정한 것이 아니라 조절될 수 있습니다. 즉, 효소 활성을 조절하여 세포가 생존하는 동안의 다양한 생리적 필요를 충족하게끔 적절히 대응할 수 있습니다.
효소 조절의 보편적인 방법은 되먹임 억제(feedback inhibition)로, 이것은 대사의 최종 산물이 그 물질의 합성에 관여하는 효소의 활성을 억제하는 것을 의미합니다. 예를 들어, 이소류신은 트레오닌으로부터 여러 반응 단계를 거쳐 합성됩니다. 이소류신 합성의 첫 단계는 threonine deaminase라는 효소에 의해 촉진되는데, 이 효소는 반응의 최종 생성물인 이소류신에 의해 억제됩니다. 그러므로 세포 안에 적절한 양의 이소류신이 있는 경우 이 효소의 활성을 억제하여 더 이상의 이소류신을 합성하지 못하게 합니다. 만일 이소류신의 농도가 감소하면 이 효소의 활성이 더 이상 억제되지 않으므로 되먹임 억제가 해제되어서 추가로 이소류신이 합성됩니다. 세포는 이 효소의 활성을 조절하여 필요한 만큼 이소류신을 합성하며 필요 이상의 이소류신 합성에 따른 에너지 낭비를 방지합니다.
되먹임 억제는 효소의 조절 부위에 결합하는 분자들에 의해 효소의 활성이 조절되는 다른 자리 입체성 조절(allosteric regulation)의 한 종류입니다. 다른 자리 입체성 조절이라는 용어는 '다른'이라는 의미의 'allo'와 '자리'라는 뜻의 'steric'에서 유래되어, 조절 물질이 단백질의 활성부위가 아닌 다른 자리에 결합하여 효소 활성이 조절되는 것을 의미합니다.
조절물질의 결합에 의해 단백질인 효소의 3차원 구조가 변함에 따라서, 효소의 활성 부위의 모양과 효소의 활성도가 변하게 됩니다. 앞에서 예를 든 threonine deaminase의 경우, 조절 물질인 이소류신의 결합에 의해 효소 활성이 억제됩니다. 어떤 경우에는 조절 물질이 촉진제로 작용하여 효소의 활성이 촉진되기도 합니다.

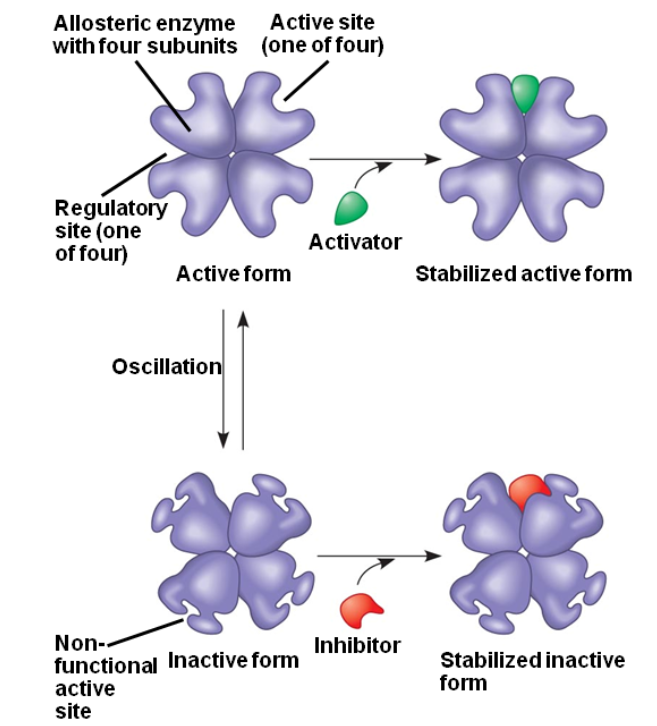
- 저해제가 없는 경우에는 기지링 효소의 활성부위에 결합하여 반응이 진행됩니다. 저해제가 allosteric site에 결합하면 활성부위의 구조 변화가 유도되어 기질이 결합할 수 없습니다.
또한 효소 활성은 다른 단백질과의 상호작용이나 세린, 트레오닌, 티로신에 인산이 결합하는 경우에서처럼 공유결합에 의해 조절될 수도 있습니다. 인산화(phosphorylation) 반응은 특히 효소 활성을 조절하는 대표적인 작용 기전의 하나로, 인산기의 첨가를 통해 다양한 종류의 많은 효소들의 활성을 증가시키거나 감소시킵니다. 예를 들면, 근육세포에서 에피네프린(아드레날린)에 의해 글리코겐이 포도당으로 분해되고, 이 포도당은 근육의 활동을 위한 에너지원으로 사용됩니다. 글리코겐의 분해는 glycogen phosphorylase에 의해 촉진되는데, 이 효소는 에피네프린이 세포 표면 수용체에 결합함으로써 인산화되어 활성을 나타내게 됩니다. 단백질의 인산화는 대사 작용뿐만 아니라 세포 성장 및 분화를 포함한 여러 세포 내 기능을 조절하는 데 있어 중요한 역할을 합니다.
'세포학' 카테고리의 다른 글
| 핵산 혼성화(nucleic acid hybridization) (0) | 2022.03.24 |
|---|---|
| PCR에 의한 DNA 증폭 (0) | 2022.03.23 |
| 효소의 주요 역할 (0) | 2022.03.20 |
| 세포 표면 돌기 (0) | 2022.03.19 |
| 미토콘드리아의 유전체계 (0) | 2022.03.18 |



